2025年12月9日,我院神经外科郭世文教授团队联合合作单位,在肿瘤学研究领域国际知名高水平学术期刊 《Cancer Letters》(中科院 1 区,JCR 分区 Q1,影响因子 10.1)上发表原创研究论文 “BTSCs exosomes derived NamiRNA-enhancer network of miR-151a-3p mediates a positive feedback loop and promotes the progression of glioma via FAK phosphorylation”(中文题目:脑肿瘤干细胞外泌体衍生的核 miR-151a-3p 增强子网络介导正反馈回路并通过 FAK 磷酸化促进胶质瘤进展)。该研究系统揭示了缺氧脑肿瘤干细胞通过外泌体传递“核激活 microRNA”,驱动胶质瘤进展的全新分子机制,并进一步验证了潜在靶向药物的治疗作用,为胶质瘤的精准干预提供了新的理论依据。

胶质母细胞瘤治疗面临的核心挑战
胶质母细胞瘤(glioblastoma multiforme,GBM)是恶性程度最高、侵袭性最强的原发性脑肿瘤之一,其治疗一直是神经肿瘤学领域的重大难题。流行病学数据显示,GBM 患者的中位生存期不足15个月,超过70%的患者在接受标准治疗后一年内发生复发。这一不良预后的关键原因在于脑肿瘤干细胞(brain tumour stem cells,BTSCs)的存在。这类细胞具有较强的自我更新和分化能力,能够在治疗后残存并重新驱动肿瘤生长。尤其值得关注的是,肿瘤微环境中的缺氧状态不仅未能抑制 BTSCs,反而进一步增强了其恶性生物学行为。
缺氧 BTSCs 外泌体的关键作用机制
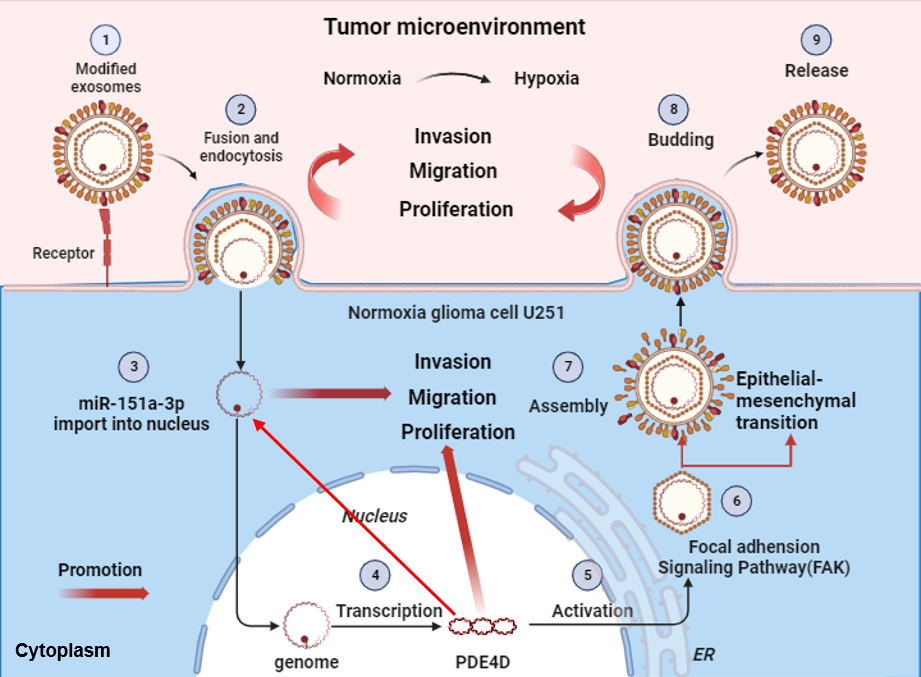
近年来研究发现,BTSCs 在缺氧条件下会大量释放外泌体,这些纳米级囊泡可携带多种蛋白和核酸分子,在肿瘤微环境中介导细胞间信息传递。然而,缺氧BTSCs 来源的外泌体如何具体调控胶质瘤进展,其核心分子及作用机制仍不清楚。
针对这一科学问题,研究团队开展了系统研究。通过高通量测序分析,团队发现缺氧BTSCs来源外泌体中miR-151a-3p显著富集。进一步研究证实,该miRNA属于一种新型的核激活microRNA(nuclear activating miRNA,NamiRNA),能够进入细胞核发挥调控作用,其功能模式与传统在细胞质中抑制靶基因表达的 microRNA 明显不同。
机制研究显示,在细胞核内,miR-151a-3p可特异性结合 PDE4D 基因的增强子区域,启动其转录。PDE4D 蛋白表达上调后,与黏着斑激酶(focal adhesion kinase,FAK)相互作用,进一步激活YAP信号通路,从而促进胶质瘤细胞的增殖与侵袭。与此同时,PDE4D信号的激活又可反向增强miR-151a-3p的表达,形成一个自我强化的正反馈环路,为肿瘤持续进展提供动力支持。
在此基础上,研究团队通过分子对接技术从药物库中筛选潜在PDE4D靶向化合物,并最终聚焦于已获批的MET抑制剂——卡马替尼(Capmatinib)。动物实验结果显示,卡马替尼在体内具有良好的安全性,主要脏器未见明显病理学损伤。
研究意义与未来展望
本研究首次系统阐明了缺氧 BTSCs 来源外泌体通过“核内 microRNA-增强子网络”驱动胶质瘤进展的完整机制,不仅为理解GBM的复发和耐药提供了新的理论视角,也为开发靶向BTSCs的精准治疗策略提供了重要依据。
值得关注的是,卡马替尼作为已获批上市药物,具有明确的临床安全性数据,为“老药新用”和加速临床转化提供了现实可能。未来,研究团队将进一步深入解析该信号通路的调控网络,优化靶向干预策略,推动基础研究成果向临床应用转化。
本文由我院神经外科郭世文教授与兰州大学第二医院神经外科潘亚文教授共同担任通讯作者。第一作者为神经外科祁洲博士和南方医科大学珠江医院张祎年教授。该研究工作得到陕西省重点研发计划等项目的资助,体现了郭世文教授团队在胶质瘤复发机制研究领域的持续深入探索。
