
近日,我院刘冰 教授 团队在《Advanced Science》 封面 发表了题为《Cinnamic-Hydroxamic-Acid Derivatives Exhibit Antibiotic, Anti-Biofilm, and Supercoiling Relaxation Properties by Targeting Bacterial Nucleoid-Associated Protein HU》的研究论文。该研究从细菌的天敌 “ 噬菌体 ” 入手,基于噬菌体天然的抑菌机制,创新性地开发出一类可精准靶向细菌类核相关蛋白HU的小分子候选药物——肉桂羟肟酸衍生物(CHADs),为解决全球抗生素耐药问题提供了全新策略。
全球范围内,抗生素耐药性正以前所未有的速度蔓延。据预测,若无全新机制抗菌药物问世,至2050年,耐药菌感染每年将导致约一千万人死亡,成为比癌症更为严峻的公共卫生挑战。传统抗生素靶点如细胞壁合成酶、拓扑异构酶等因长期使用已普遍面临耐药压力,开发作用于全新靶点、且不易诱发耐药突变的抗生素,成为当前抗感染领域亟待突破的关键难题。
细菌类核相关蛋白HU在几乎所有病原菌中高度保守,负责维持基因组三维结构、调控DNA超螺旋、参与生物膜形成等多种核心生命过程。然而,由于HU缺乏典型酶活性,长期以来难以被作为可行的药物靶点。
针对这一困境,研究团队从噬菌体抑制HU的天然策略中获得关键启示。刘冰、王亚文团队曾在PNAS报道,SPO1噬菌体分泌Gp46蛋白,通过特异性结合HU并阻断其与DNA的相互作用,导致细菌基因组失去结构稳定性,最终导致死亡,从而实现高效“结构性杀菌”。基于此机制,团队提出设想:能否开发出可模拟Gp46功能的小分子抑制剂,将HU转化为可成药的抗菌靶点?
为实现这一目标,研究团队运用华为科技的“盘古”药物大模型构建虚拟筛选体系,系统评估了DrugBank数据库中数千种化合物与HU–DNA界面的结合潜力。筛选结果显示,一类含有“肉桂羟肟酸”骨架的小分子可高度模拟Gp46的作用模式,稳定占据HU关键结合区域。研究团队据此将该类分子命名为:肉桂羟肟酸衍生物(cinnamic-hydroxamic-acid derivatives,CHADs),并展开系统性功能验证。
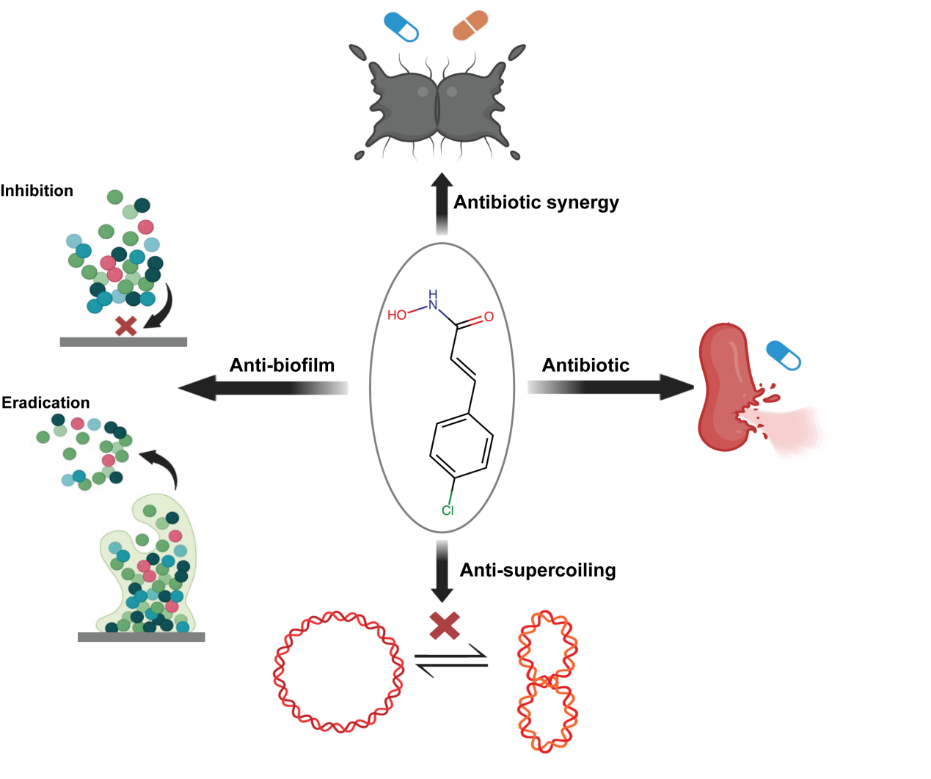
研究团队根据HU蛋白的特性与其参与的生物学功能,从核区解构、DNA拓扑紊乱到生物膜破坏,多角度地验证了CHADs对细菌生存的影响。CHADs处理后的细菌表现出典型的HU功能受损表型——核质弥散、细胞形态拉长、染色质结构紊乱。生化实验进一步证明CHADs可直接抑制HU与DNA的结合,从根本上破坏细菌基因组的三维结构组织。这种 “ 结构性杀菌 ” 方式不同于传统的代谢抑制或细胞壁靶向抗生素,它从细菌生命的最核心层面切断了生存基础。
更令人关注的是,CHADs在DNA拓扑调控中展现出一种前所未有的作用方式。团队利用bTMP探针和转录组学分析发现,CHADs能显著降低DNA超螺旋度,引发数百条基因通路的重编程,大幅削弱细菌面对环境压力时的动态调控能力。这种“非拓扑酶依赖”的拓扑紊乱机制,区别于喹诺酮类等传统抗生素的酶抑制模式,为抗菌药物在拓扑层面的创新提供了全新思路。
与此同时,由于HU会被细菌主动外排到细胞外,与环境eDNA结合并成为生物膜形成提供骨架。CHADs对细菌生物膜的抑制也表现出显著的普适性。在金黄色葡萄球菌和铜绿假单胞菌等菌种中,CHADs不仅阻断生物膜的形成,还会使成熟生物膜呈现松散、易崩解的结构特征。其分子基础在于HU抑制导致DNA构象从稳定的Z-DNA向更脆弱的B-DNA转变,使生物膜失去关键的结构支撑。这种基于“构象变化”驱动的破坏策略,不依赖菌种特异通路,也更不容易产生耐药性。
在抗菌效果验证中,CHADs展现出跨革兰阳性和革兰阴性多种重要致病菌的广谱活性,包括金黄色葡萄球菌、鲍曼不动杆菌以及结核分枝杆菌等。团队筛选出的候选分子R4Cl的抑菌表现甚至可媲美部分经典抗菌药物。更为重要的是,CHADs的耐药频率低至~10⁻¹⁰,远低于传统抗生素,意味着细菌难以通过简单突变逃逸HU靶向机制。动物实验进一步增强了这一体系的成药潜力。无论是在小鼠皮肤感染模型,还是在脓毒症模型中,CHADs均能显著降低体内菌量并提升存活率。其安全性也通过小鼠毒理实验得到初步验证,为未来的药代动力学与成药性优化奠定基础。
实验表明,CHADs处理可导致细菌出现典型HU功能缺失表型,包括核质弥散、细胞形态异常、染色质结构紊乱等。进一步生化验证显示,CHADs能直接抑制HU与DNA的结合,从而在根本上瓦解细菌基因组的空间组织。这种以破坏基因组结构为核心的新型杀菌机制,完全区别于现有抗生素的代谢抑制或细胞壁靶向模式,展现出独特的“结构性杀菌”特征。此外,CHADs还能显著干扰DNA超螺旋状态,破坏细菌对环境压力的适应能力,并有效抑制生物膜的形成与结构稳定性,展现出多维度、系统性的抗菌效果。
该研究首次系统证实了HU作为抗菌药物靶点的“非拓扑酶依赖”,不仅为开发克服耐药菌感染的全新药物奠定了科学基础,也展示了一条从天然微生物互作中发掘抑菌策略、再通过AI手段实现小分子转化的创新研发路径。
西安交通大学第一附属医院为该论文第一完成单位,西安交通大学博士生陈欢为第一作者,帝国理工学院Steve Matthews教授、华为科技乔楠博士、华中科技大学同济医学院李岩教授、西安交通大学第一附属医院刘冰教授为共同通讯作者。研究受到国家重点研发计划和国家自然科学基金等资助。同时,研究特别感谢中国科学院武汉病毒所、华为科技有限公司的大力支持。感谢西安交通大学第一附属医院生物样本信息资源中心为研究提供了核磁共振波谱仪的实验机时和全方位支持。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202509876
